Médicament
Médicament générique : qui veut gagner des millions ?
- "Docteur, le pharmacien a dit qu'il faut mettre non substituable en toute lettre après chaque ligne."
- "Je suis plus à l'école primaire, je copie plus des lignes".
Après bien des péripéties , voilà donc ce qu'est le générique pour nous médecins : un enjeu de conflit entre médecin, patient , et pharmacien.
Le patient veut (souvent) son princeps, le pharmacien ne veut pas lui donner, car il risque des sanctions, et le médecin n'a pas envie de retourner à l'école primaire.
Et malgré tout, le taux de substitution dans ce qu'on appelle le répertoire est de l 'ordre de 75%, ce qui veut dire que sans changer les dispositions légales (le périmètre de substitution) , il est fort probable que celui ci ne puisse augmenter et stagne bien à la traine de nos voisins européens, alors que cette substitution a été mise en place en 1999 en France.
Que fait la France par rapport a ses voisins ?
En France, les médicaments génériques sont inscrits par l’Agence Française de Sécurité Sanitaire des
Produits de Santé (AFSSAPS) au répertoire des groupes génériques. Ce répertoire liste, pour chaque
médicament de référence (ou princeps), les spécialités génériques qui lui sont associées, constituant
ainsi des groupes génériques au sein desquels les présentations ont toutes le même principe actif et la
même forme pharmaceutique (dosage…).
Le droit de substitution, accordé en 1999 aux pharmaciens, ne peut s’exercer que dans le cadre
exclusif de ces groupes génériques ; aussi, les pharmaciens ne peuvent-ils substituer à un princeps
que les génériques qui lui sont associés dans le répertoire. En outre, lorsqu’ils existent, les tarifs
forfaitaires de responsabilité (TFR) ne s’appliquent qu’aux présentations d’un même groupe générique
ayant la même contenance.
Seuls le Danemark et la Suède disposent d’un répertoire formel des génériques. Un système similaire est en place en Allemagne et aux Pays-Bas, où les génériques sont classés dans des groupes de médicaments interchangeables (dits « jumbo groups » en Allemagne).
Leur champ est cependant plus large que les groupes génériques du répertoire français puisqu’ils
rassemblent non seulement les présentations ayant un même principe actif mais aussi leurs équivalents
thérapeutiques. Enfin, il n’existe pas de répertoire au Royaume-Uni.
Aux Pays-Bas, au Danemark et en Suède, les pharmaciens ont le droit de substituer un générique à un
médicament prescrit. Il s’agit même d’une obligation légale en Suède. Les pharmaciens allemands ne
disposent pas de droit légal de substitution mais sont tenus par le principe légal « d’aut-idem-rule » de
dispenser le générique qui coûtera le moins cher à l’assuré. Au Royaume-Uni, enfin, les pharmaciens
n’ont pas de droit de substitution. Cependant, lorsque la prescription est rédigée en DCI
et qu’il existe une offre générique, ils sont intéressés financièrement à la délivrance de génériques puisqu’ils ne seront remboursés que sur la base du tarif de référence (cf. page suivante). En outre, s’ils négocient auprès du fabricant un prix d’achat inférieur à ce tarif, ils peuvent conserver la différence (modulo : une ristourne – ou claw-back – reversée au NHS).
Plus généralement, l’adhésion des pharmaciens aux politiques en faveur des génériques s’est souvent
appuyée sur des incitations financières. Aux Pays-Bas, les pharmaciens ont bénéficié des remises
accordées par les fabricants de génériques. En Allemagne, la rémunération des pharmaciens ne varie
pratiquement pas en fonction du prix des médicaments. Enfin, en France, l’incitation à la substitution a
été obtenue en alignant, en valeur absolue, la marge perçue sur les génériques sur celle du princeps.
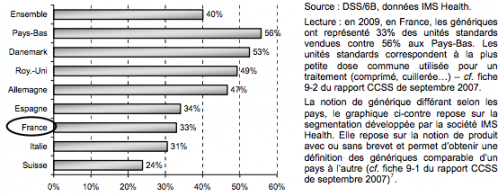
Graphique : Part de marché des génériques en volume dans le marché global (2009)
On voit donc ici que nous sommes assez loin de certains de nos voisins , et que nous n'avons aucune chance de nous hisser au niveau des Pays Bas, même en faisant recopier des lignes aux médecins.
Il faudrait en effet modifier l'autorisation de substitution, et l'élargir en autorisant par exemple la substitution par le médicament le moins cher de la classe thérapeutique.
L'industrie s'est en effet parfaitement adaptée à l'arrivée du générique, qui aurait dû représenter une véritable catastrophe : nombre de molécules représentant des chiffres d'affaires importants sont en effet tombées dans le domaine public, et ont pu de se fait être copiées.
Les industriels ont donc mis sur le marché de nouveaux produits tout a fait similaires aux produits généricables (ne nécessitant que très peu de R&D), ont obtenu des agences un prix d'achat très intéressant, et font la promotion massive de ces produits qui ne sont pas substituables.
Ces produits portent un petit surnom : les "metoo", et concernent les principales classes thérapeutiques : dans chaque classe il existe un ou plusieurs produits non substituable, dont le service rendu n'est ni meilleur et parfois moindre que le produit généricable, et pour lequel la sécurité sociale paye un prix bien supérieur à ce qui serait raisonnable.
L'exemple classique, le Crestor , dont voici la fiche commission de transparence 2005 : son service rendu est a priori en 2005 moindre que les statines de références qui sont tombées dans le domaine public.
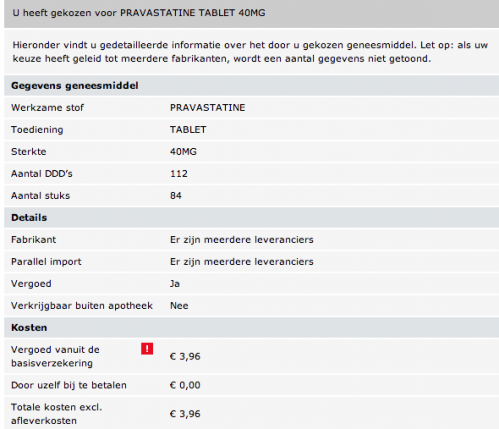
L'Elisor (pravastatine) tombe dans le domaine public en 2006, et pourra être substituée par de la pravastatine, il y a donc fort à parier que les efforts marketing portant sur l 'Elisor, qui vont profiter surtout à son générique (pravastatine) devraient s'épuiser assez vite.
Crestor qui ne rend donc pas de service meilleur que les génériques a donc toutes les chances de faire un "hit" et c'est bien ce qui va se produire : 6,6 milliards de dollars de chiffre d affaire en 2011, et le Crestor va couter en 2012 la modique somme de 338 millions d 'euros à la sécurité sociale.
prix du crestor 2013 (source Eurekasanté)
prix de la pravastatine arrow 2013 (source Eurekasanté)
Le Tahor, atorvastatine, qui occupait la première position en 2011, chute à la 7e position, avec 242 millions d'euros de remboursement. Cette baisse drastique, de 48,4% en un an, est due à sa générication en avril 2012.
Dans un cas comme dans l 'autre, rien ne venait justifier cette dépense sur un plan médical ou scientifique, le générique faisant même mieux, jusqu'à preuve du contraire.
Les règles françaises de substitution protègent donc ces metoo, avec la bénédiction ministérielle et du législateur, pendant que les commentateurs économiques se désolent du faible taux de substitution en France, en relayant le discours inopérant qui nous est servi depuis bientôt treize années.
Les pays qui ont un plus fort taux de substitution autorisent simplement a délivrer un produit à la place de ces metoo.
On nous cache tout on nous dit rien
Mais au delà du fait que le dispositif légal réserve un chiffre d'affaire injustifié à des produits pseudo innovants, qu 'en est til du prix consenti au générique en France par nos autorités?
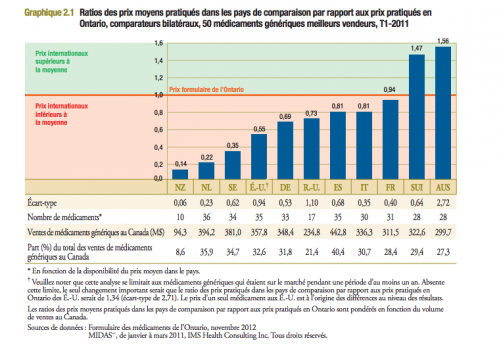
La réponse se trouve ci dessous, issue d’une étude canadienne.
On voit que la France consent des prix élevés , y compris à des médicaments tombés dans le domaine public. La nouvelle zélande , qui performe, a mis en place un systême d’enchères en 1996.
Les pays bas ont fait baisser les prix de leurs génériques de 60% en deux ans (2007/2009), sans faire écrire des petites lignes "non substituable" à leurs médecins, mais en pratiquant une politique d’achat au bénéfice de l’assuré plutôt qu’au bénéfice de l ’industriel.
Les prix pratiqués sont fréquemment 15 fois moindre qu'en France pour des produits strictement similaires....et peuvent donc être remboursés à 100% par les assureurs en santé.
Oui vous avez bien lu : le même produit est vendu quinze fois moins cher dans certains pays d'Europe, et l 'industriel qui le vend ne fait pas faillite.
Reprenons notre Crestor à 100 euros la boite de 90, et substituons lui la pravastatine qui est similaire en terme de résultats, ouf on est à 37 euros pour le dosage maximum et similaire.
Aux pays bas , le même produit généruqe fabriqué selon les mêmes normes de qualité et souvent par le même laboratoire se trouve lui à ....3 euros 96 pour une boite de 84 cp au lieu de 90. Soit une économie de 97% pour un résultat médicalement identique.
Inexium, autre célébrité parmi les metoo en dosage à 40mg coute 15E93 la boite de 28 ; l'équivalent générique , lui est à 9E74 (omeprazole 20Mg).
Au pays bas, la boite de 15 cp est à 0,39 euros pour un résultat médical identique soit trente fois moins cher.
Voici l'adresse du lien donnant les prix des médicaments, pour ceux qui souhaiteraient jouer à "qui veut gagner des millions".
Pendant ce temps, la sécurité sociale va continuer à me verser une prime selon le nombre de boites de génériques qui ont été substituées par le pharmacien (coût de l'informatique qui permet de compter les boites de génériques qui me sont "attribuées?").
Il va très certainement falloir faire une nouvelle campagne de communication sur le thème du générique.
Et puis les commentateurs économiques vont reprendre en boucle le discours convenu sur "ces patients et ces médecins irresponsables qui plombent l 'assurance maladie".
Alors si le médicament en général et le générique en particulier participent simplement au subventionement de l 'emploi et de l'industrie en France, grâce à une fixation délirante des prix d'achats par le CEPS, qu 'on nous le dise clairement ; on pourrait mettre une vignette "participe au financement philanthropique des industriels de la pharmacie" sur les boites, ou peut-être créer un pharmathon en 2015, les choses seraient ainsi plus lisibles.
Autre alternative : mutualiser les achats avec les pays bas, ça peut se faire en six mois, au bénéfice des deux pays.
Je vous parlerai une prochaine fois de la qualité des génériques, en attendant, continuons à jouer !
Nouveaux anticoagulants : inventons la SlowPharmacie
Vu de mon cabinet de médecine générale et en parlant avec les collègues, notre expérience (non significative, non représentative, non statistiquement vérifiable) ne semble pas très positive concernant les NACO.
Il s'agit là d'une nouvelle classe d'anticoagulants oraux qui a l'avantage de ne pas nécessiter de prise de sang de contrôle, mais qui a deux inconvénients non négligeables :
- leur coût , autour de 40 euros pour un mois de traitement (dabigatran) contre 2 à 6 euros pour la warfarine (auquel il faut ajouter le coût du contrôle d INR par prise de sang).
- l'absence d'antidote en cas de saignement lié à une surdose ou une hémorragie liée à un choc (vitamine K pour ce qui est de la warfarine).
Nous voyons beaucoup de traitements anticoagulants par AVK changés par les spécialistes lors du contrôle annuel, on peut dire en tout cas que comme les pilules 3G, les généralistes ne sont pas "à la manoeuvre" et sont plutôt circonspects.
Et nous voyons les premières hospitalisations pour iatrogénie, qui nous semblent un peu trop fréquentes (mais encore une fois non significatives statistiquement).
Les questions qui se posent ici sont les mêmes que celles qui ont concerné les glitazones, ou une majorité de traitements innovants récents (pilules 3G) : leurs indications et bénéfices ne sont pas nuls, loin s 'en faut, mais leurs indications, contre indications, effets secondaires sont une fois de plus mal anticipés.
Et la prescription massive à des populations qui n'en tirent pas bénéfice (versus les "vieux traitements") expose à deux choses : un coût inadmissible au vu de l 'absence de bénéfice médical, et des effets secondaires à la mesure de l'explosion des prescriptions injustifiées : si l'on prescrivait 3 grammes d'aspirine par jour a quatre millions de Français, nous aurions une hécatombe.
La stratégie des laboratoires est de rapidement "exploser le marché" et réussir à transformer une majorité de vieilles prescriptions d' AVK en prescription de NACO, pour une simple raison : ne pas laisser les concurrents s'implanter, car une fois le changement de traitement vers un NACO réalisé, la retransformation de prescription est incertaine.
Concernant le diabigatran, on constate que la documentation d’accidents cardiaques plus fréquents (+33%) aurait sans doute nécessité une restriction d 'AMM dans un premier temps. (ici aussi). Je ne vois hélas rien à ce sujet de ce coté de l 'atlantique.
Les valves cardiaques sont maintenant aussi clairement une contre indication ( étude REALIGN et décisions FDA/EMA) , ainsi que l 'insuffisance rénale (qui a été prise en compte dès le lancement).
J ai été surpris personnellement par certaines données US, données a posteriori puisqu'émanant des notifications d'accidents à la FDA (et qui contredisent les données rassurantes de RE-LY 2009).
La mortalité par saignement est en effet relevée à 638 contre 44 pour la warfarine 2011/2012 , alors que le nombre de consommateurs de diabigatran est bien moindre.
Et plus récemment, une analyse des données de notification a inspiré cet article.
On y retient 4000 saignements sous diabigatran avec 638 décès contre 800 événements sous warfarine avec 44 décès : le ratio événements sur nombre de décès indique qu'en cas de saignement, ça semble se passer nettement moins bien sans antidote (trois fois plus de décès, 15% contre 5,5%).
Et le nombre absolu semble important car la consommation de diabigatran est bien moindre que celle de warfarine.
Seule une sous notification massive des événements sous warfarine est à même d'expliquer ce différentiel, mais cette explication semble bien fragile.
Allons nous une fois encore assister au retrait de ces nouvelles molécules dans un délai de un an, alors qu'elles ne sont pas inintéressantes ?
La responsabilité n'en revient pas aux chercheurs, mais au circuit de commercialisation, et aux circuits de contrôle sanitaire, qui oublient de donner du temps, et de limiter les indications, exposant massivement des patients qui ne tirent aucun bénéfice de molécules innovantes, puisque déjà bien traités avec de vieux médicaments bien connus (et bien moins coûteux).
Nous assistons à la répétition de cette façon de procéder depuis une dizaine d'années (Coxib , Cerivastatine, Glitazones...).
Il reste donc à inventer la SlowPharmacie, au bénéfice de tous ; et même celui des laboratoires, qui n'auront pas à gérer les aspects juridiques liés a ces lancements chaotiques et effrayants.
Restreindre les indications à des populations ciblées en limitant ainsi le risque est la bonne façon de procéder. C'est aussi redonner du pouvoir aux chercheurs, aux patients et aux soignants, au détriment des marketeurs et des financiers.
En attendant, l’étude de Karen Lasser (2002) reste pleinement pertinente : évitons de prescrire le dernier médicament à la mode !
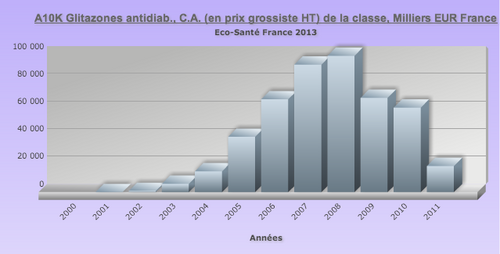
Fast Pharmacie typique : Glitazones : introduction, puis premier chiffre d'affaire dans la classe antidiabétiques oraux, puis retrait (cancers de la vessie, événements cardiovasculaires).
Communiqué de presse de l 'ANSM portant sur le mésusage et les accidents de braguette *
LA BRAGUETTE La Braguette® (Dérivé de braie, brague issu du latin braca et sans doute d’origine celte) est indiquée dans l'ouverture du pantalon, féminin ou masculin, soit en mono utilisation , soit en association avec des systêmes à base de bouton.
Du fait de signalements de cas d’accidents, et de détournement avec les formes à bouton, la braguette fait l'objet d'une enquête officielle de matério vigilance et d’un suivi continu depuis 2006.
En particulier, l'étude publiée dans le journal anglais d'urologie fait état de 17616 accidents de braguette entre 2002 et 2010.
Les résultats de ce suivi ont confirmé une très forte proportion d'utilisations hors AMM et un usage détourné chez les femmes, qui pourraient aussi bien porter des jupes ou des robes. Au vu de l’ensemble de ces éléments, un Plan de Gestion des Risques a été mis en place en 2008 par les fabricants, à la demande de l’Agence.
Une actualisation de l’enquête de matério vigilance a été faite en 2010 puis en 2011. Compte tenu de la persistance de la très forte proportion, d'usages hors-AMM, des cas d’abus et de dépendance et d’un important trafic, la durée maximale d'usage de la braguette a été réduite à 12 semaines.
En outre, depuis septembre 2011, la prescription de la braguette pour les patients ambulatoires doit être faite en toutes lettres et sur ordonnance sécurisée.
Enfin, à compter du 15 mars 2012, la prescription initiale et le renouvellement annuel seront réservés aux urologues et aux pédiatres. Les renouvellements intermédiaires pourront être effectués par tout médecin. Une mise au point sur l’arrêt de l’utilisation hors AMM de la braguette a été diffusée en décembre 2011 aux professionnels de santé en décembre 2011 pour les aider dans la prise en charge du patient, afin d’initialiser l’arrêt de la braguette et de proposer des dispositifs à bouton.
* Toute ressemblance avec un communiqué de l 'ANSM portant sur le rivotril serait purement fortuite
IGAS : l' apolitique du médicament
DR Y Le Flohic
Elu MG France aux URPS de Bretagne
Lettre ouverte à l'IGAS.
Bonjour Madame,
J 'ai tenté de joindre l IGAS suite au rapport sur le générique rendu publique ce jour, et hélas personne n'est joignable.
Ce rapport et ses conclusions ne tiennent simplement pas compte d'une très simple donnée : le bon sens.
Dans l'industrie, comme dans la moindre association regroupant des acheteurs, quand des achats en volume sont effectués par ce que l'on nomme un acheteur, celui ci négocie, et achète en fixant un prix équivalent pour des produits et prestations équivalentes.
Tout acheteur qui procéderait différemment dans l'industrie, se verrait accusé de détourner des fonds, au profit d'un vendeur qu'il accepterait de surpayer pour un produit considéré comme similaire ; il serait licencié et trainé devant les tribunaux par son employeur.
C'est pourtant ainsi qu'agit l'acheteur des médicaments en France (CEPS) , acceptant de donner plus à certains laboratoires pour certains médicaments considérés comme équivalents par les autorités sanitaires ; acceptant de nouveaux "meetoo" copies inutiles de médicaments dont on se demande par quel mécanisme ils se voient attribuer des prix de remboursement (donc d achat par la sécurité sociale) supérieurs aux génériques ; ceci sans une once de justification scientifique ou technique, et bien au contraire , si on en croit le battage médiatique pro génériques.
Forts de ces constats qui n'échapperaient pas à un paysan béarnais, l 'IGAS trouve le moyen de proposer un système de malus pour les médecins prescripteurs.
La responsabilité des médecins (et c'est déjà compliqué) est de prescrire la bonne molécule, votre responsabilité IGAS , CEPS, gouvernement est de fixer le prix des médicaments, et de donner de justes orientations à notre système de soins solidaire.
Reporter cette responsabilité sur les prescripteurs et les patients devient proprement inadmissible, inaudible, et discrédite un peu plus les autorités sanitaires.
Les économies que l'on aurait été en droit d attendre de la "tombée" dans le domaine public de nombre de médicaments ont été grevées par des dépenses inadmissibles, du seul fait et de la seule responsabilité des autorités sanitaires françaises ; les campagnes publicitaires coûteuses, la "surmarge" accordée aux pharmaciens, le comptage des boites délivrées par chaque médecin (quel coût extraordinaire informatiques?) , tout cela n'eut pas existé si simplement les autorités sanitaires avaient fait leur travail : définir un prix de médicament s'appliquant a l 'ensemble des médicaments, princeps et génériques, de qualité équivalente.
L'IGAS trouve le moyen de proposer maintenant un bonus/malus aux prescripteurs ; de qui se moque t on?
Plus grave, c'est précisément cette différence de prix qui accrédite l'idée auprès du public que la qualité des génériques n'est pas la même que celle des princeps, constat également fait par le paysan béarnais : les prescripteurs se retrouvent dans la situation paradoxale qu'avant tout ce battage, la prescription en DCI et générique ne posait aucun problème, et que celle ci devient problématique en raison de suspicions légitimes, dues aux divergences de prix, et a certaines problématiques spécifiques (antiépileptiques en particulier qui ont donné lieu a des expertises et a des communications laborieuses sur la biodisponibilité).
Soucieux des économies du système de santé, et de la sérénité des prescripteurs, il me semble nécessaire,
plutôt que de pondre un énième rapport de 143 pages sur le sujet, de proposer des mesures de bon sens :
- proposer une mission d'enquête parlementaire sur la raison de fixation de prix différents pour des produits similaires, par le CEPS et réforme du CEPS.
- délivrer une information de qualité , permettant de connaitre les produits réellement équivalents (fabriqués dans les mêmes unités de production, avec les même excipients ,et les mêmes biodisponibilités)
Et enfin, après tant d'années d'errance, que les autorités sanitaires prennent en main leurs responsabilités dans la fixation du prix des médicaments, car nous atteignons là un point de non retour en terme d'absurdité, de lâcheté et de report sur des professionnels de santé et sur les patients de responsabilités qui ne leur incombent pas.
Des médecins ont été agressés pour avoir refusé d'apposer la mention "non substituable" sur leur ordonnance, et il est donc grand temps d'agir sérieusement sur ce sujet.
Dr Y Le Flohic
Elu aux URPS de Bretagne